油茶叶提取物的5α-还原酶抑制活性及化学成分分析(二)
1.2.4油茶树提取液的配制及5α-R抑止活力的测量
1.2.4.1不一样芳烃油荼叶提取液的配制及提取率的测算
油荼叶除去变病历经选择,45℃烘干箱干躁,破碎过60目筛,称量8份20g油荼叶粉末状按1:40(w:v)料液比各自添加水、50%乙醇溶液、工业甲醇、酒精、正丁醇、乙酸丁酯、二氯甲烷、乙醚,先拌和泡浸3h再于50℃下超声波震荡获取2次(2h/次),4000r/min离心式10min促使固液分离设备,上清液转动挥发缓解压力浓缩去除有机化学实验试剂,随后真空泵低温干燥,获得不一样极性溶剂的油茶树粗提取液各自记作A1-~A8,观查其色泽及特性,并测算得率,计算方法如下所示:
得率%=100×m//M(4)
式中m为提取液的品质(g),M为原材料干基品质(g)。
1.2.4.2油荼叶提取液5α-R抑止活力的测量
各自取A1~A8干冻粉末,用50%酒精均配置成200μg/mL的封闭液,依照1.2.2测量A1-A8封闭液对5α-R的抑制率,以5α-R抑制率为指标值,明确最好制取有机溶剂,并测量、测算最好有机溶剂提取液对5α-R活力的半抑止浓度值(IC50),有关计算方法同公式计算(3)。
1.2.5油茶树提取液总酚和黄酮类物质成分的测量
用50%乙醇溶液将A1~A8配置成1mg/mL的封闭液,选用Folin-Ciocalteu法,以没食子酸计,测量不一样油荼叶提取液中的总酚成分。标曲的制取:配置梯度方向浓度值的芦丁水溶液0~50μg/mL。在1mL管理体系中先后添加100μL没食子酸水溶液,250μL的福林酚试剂,250μL的15%的碳酸钠溶液,再补充400μL水至1mL终容积。充足搅拌以后80℃水浴置放30min,静放制冷10min,4000r/min离心式5min,取上清液于778nm测量吸光度值A778。根据没食子酸规范溶液的浓度和相对应的吸光度值制作标曲。试品的测量:实际操作跟上面一样,将试品吸光度值带到标曲,以没食子酸计,算得试品总酚成分。
选用亚硝酸钠-硝酸铝-氢氧化钠溶液着色法,以芦丁计,测量不一样有机溶剂植物提取中黄酮类物质的成分。标曲的制取:高精密配置梯度方向浓度值的芦丁水溶液0~50μg/mL。汲取200μL被测芦丁水溶液,放置5mL试管婴儿中,添加300μL60%乙醇溶液,再添加100μL亚硝酸钠水溶液,混匀,置放6min,添加150μL硝酸铝水溶液,混匀,置放6min,添加400μL氢氧化钠溶液水溶液,最终添加1.35mL60%乙醇溶液至终管理体系为2.5mL,混匀,置放15min,于510nm测量吸光度值A510。根据芦丁规范溶液的浓度和相对应的吸光度值制作标曲。试品的测量:实际操作跟上面一样,将试品吸光度值带到标曲,以芦丁计,算得试品黄酮类物质成分。
1.2.6超高效率液相色谱仪串连三重四极杆航行時间质谱分析(UPLC-TRIPLETOF-MS/MS)剖析评定油荼叶提取液的有机化学成分
参照刘蕾的办法获得8mg油荼叶50%酒精提取液,添加2mL工业甲醇,配置成4mg/mL的提取液待测液,超声波5min完用0.22μm微孔滤膜过虑至高效液相瓶中,被测。
离子交换柱:C18柱(2.1mm×150mm,1.8μm);流动性相:0.1%苯甲酸-溶液(流动性相A)和乙腈(流动性相B);梯度方向过柱标准:0~10min,5%~13%B;10~20min,13%B;20~40min,13%~20%B;40~60min,20%~45%B;60~70min,45%~100%B;进样量:10µL;流动速度:1mL/min;柱温:35℃;检验光波长:280nm。
UPLC-TripleTOF5600 航行時间液质联用仪:空气负离子逐行扫描;扫描仪范畴:m/z100-2000;做雾化气(GS1):55psi;做雾化气(GS2):55psi;气帘气(CUR):35psi;离子源溫度(TEM):550℃(负);离子源工作电压(IS):-4500V(负);一级扫描仪:去簇工作电压(DP):100V;对焦工作电压(CE):10V;二级扫描仪:应用TOFMS-ProductIon-IDA方式收集质谱分析数据信息,CID动能为20、40和60V,气相前,用CDS泵做品质轴校准,使品质轴偏差低于2ppm。
1.3数据处理方法
选用EXCEL手机软件开展数据统计分析(每组数据信息均用±s来表明);用GraphpadPrism6.0制作曲线图、柱形图;相关分析选用SPSS中Pearson相关分析统计分析检测(*P<0.05)。
2結果与探讨
2.15α-R粗酶提取液蛋白质成分
粗酶提取液展现淡粉色,选用Bradford法对5α-R粗酶提取液定量分析,以蛋白质含量表明。测得蛋白标曲为y=0.5753x 0.5269(y为吸光度值,x为规范蛋白质浓度值,R2=0.9977),算得浓度值为12.12mg/mL。
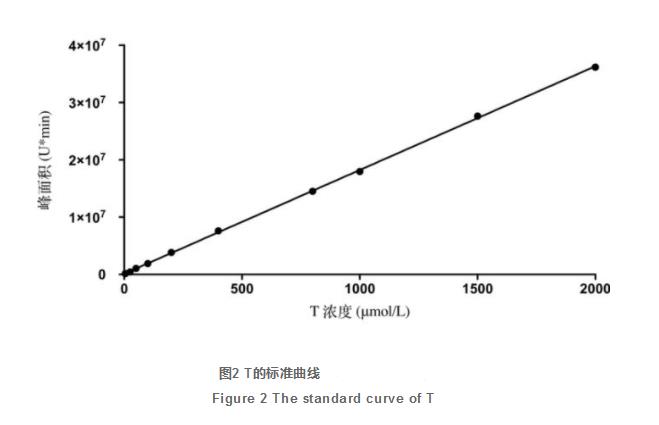
2.2T的标曲
如图2所显示,T在5μmol/L~2000μmol/L范畴内展现较好的线性相关,线性回归方程为y=18110x 116886(R²=0.9998)。
2.3酶促反应管理体系的明确
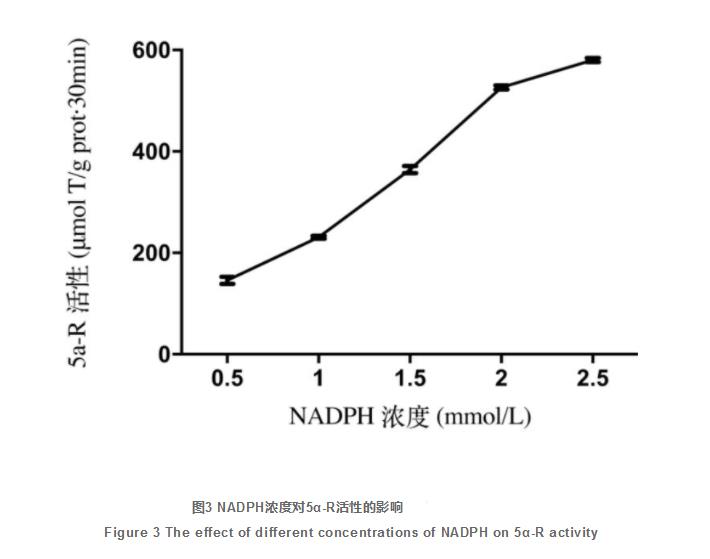
如图所示3所显示,在0~2mmol/L范畴内,伴随着NADPH浓度值的提升,酶促反应持续升高,当NADPH浓度值再提升时对酶促反应的危害并不大,并且充分考虑NADPH价格比较贵,故最后挑选2mmol/L做为NADPH在5α-R酶促反应管理体系中的适合加上浓度值。如图4所显示,在0.1~2mmoL范畴内,伴随着T浓度值的提升,酶促反应持续升高,挑选酶促反应最大时相匹配的2mmol/L做为T在5α-R酶促反应管理体系中的适合加上浓度值。如图所示5所显示,5α-R提取液浓度值在0.38~0.76mg/mL范畴时,伴随着提取液浓度值提升,酶魅力慢慢升高,在含量为0.76mg/mL时到达最大值,以后伴随着提取液浓度值的扩大酶魅力反倒减少,因而明确0.76mg/mL为5α-R提取液浓度值在5α-R酶促反应管理体系中的适合加上浓度值。
最后确认的反映标准以下:pH为7.4的聚磷酸盐缓冲溶液300μL,加上浓度值为0.76mg/mL的粗酶提取液500μL,加上浓度值为2mmol/L的T50μL,试品50μL,加上浓度值为2mmol/L的NADPH100μL,反映溫度为37℃,反应速度为30min。
文章版权备注
- 2023-05-01奶味香精的制备技术与开发现状
- 2023-04-04阿魏酸及其衍生物在食品添加剂领域研究进展(一)
- 2023-03-23甘肃省榆中县市场监督管理局强化食品快检 筑牢食品安全防线
- 2023-03-23常德:专项整治酒类市场12种违法行为
- 2023-03-23贵州这7批次食品检出食品添加剂问题,有食用植物调和油、冰糖大蒜、无油剁椒等
- 2023-03-23怀化:部署开展制止餐饮浪费专项行动
- 2023-03-23超90%展商已确认展位 6月食品原料展带来海内外商机
- 2023-03-23关于召开2023年国际食品安全与健康大会的通知
- 2023-03-23河南省市场监管局召开落实食品安全“两个责任”暨制止餐饮浪费专项行动调度视频会议
- 2023-03-23邵阳市食品安全“两个责任”机制推进暨野生蘑菇中毒防控部署电视电话会议召开

 豫ICP备19024296号
豫ICP备19024296号 售前咨询
售前咨询