2.2γ-PGA对谷蛋白水份遍布的危害
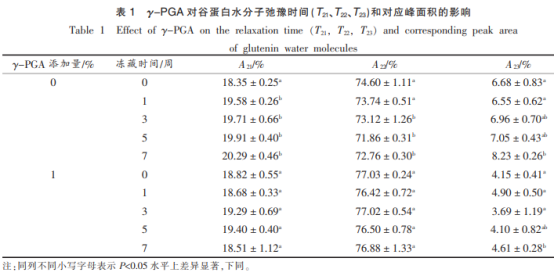
1为γ-PGA对谷蛋白水分弛豫时间(T21、T22、T23)和相匹配峰总面积的危害,谷蛋白中水分是由束缚水T21、弱束缚水T22和自由水T23三一部分水份构成。得知随冻藏時间提升,空缺组中弱束缚水呈下降趋势,而自由水成分却由6.7%上下明显扩大至8.2%上下,这是由于冻藏期内冰霜的重结晶状况促使谷蛋白中间的化学交联功效变弱,造成 蛋白质与水的融合水平减少,引起一部分弱束缚水向自由水转换。而在γ-PGA组,发觉冻藏前期其自由水成分比空缺组小2.5%,而弱束缚水相对性成分却增大,说明γ-PGA的加上更改了谷蛋白的水份遍布,较少的自由水使其更为平稳。与此同时γPGA合理遏制了谷蛋白冻藏期内的水份转移,冻藏7星期过后其自由水成分较空缺组低3.5%。比照γPGA对面条蛋白质冻藏期内水份转变危害,实验发觉谷蛋白与面条蛋白质冻藏期内弱束缚水和自由水的趋势分析一致,从而说明γ-PGA根据抑止谷蛋白的水份转移进而影响到了面条蛋白质冻藏期内的水份转移。
2.3γ-PGA对谷蛋白二级结构的危害
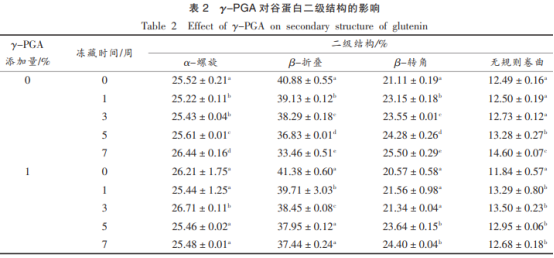
表2为γ-PGA对谷蛋白二级结构中各成份相对性成分的危害,谷蛋白中α-螺旋式、β-伸缩、β-拐角、无规律打卷的相应成分各自为25.5%,40.8%,21.1%,12.5%。随冻藏時间增加,γ-PGA组β-伸缩相对性成分由41.4%降低至37.4%上下,无规律打卷相对性成分明显提升1.5%。二级结构的更改一方面很有可能是由于伴随着冻藏時间的增加,谷蛋白中重结晶状况促使谷蛋白生物大分子因机械设备力而解聚,使其井然有序情况向混乱情况转换,另一方面是由于冻藏造成 蛋白质分子间氢键的毁坏,促使亲水性与亲水性官能团曝露引起的蛋白质分子结构间和分子结构里面的再次化学交联。与空缺对比,蛋白质二级结构中做为混乱构造的β-拐角、无规律打卷的增大幅缓解,比较平稳的合理情况的α-螺旋式、β-伸缩减少力度减少也说明γ-PGA能够具有冰霜装饰功效,降低大冰霜的产生,进而维护谷蛋白生物大分子,消弱冻藏造成 的井然有序向混乱转换。
2.4γ-PGA对谷蛋白热学的影
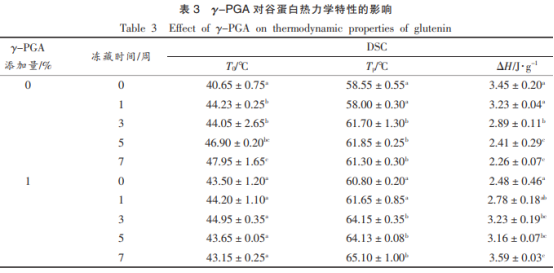
转性溫度(Tp)和焓变(ΔH)是蛋白质在热变性过程中的基本参数,蛋白质试品热学特点如表3所显示,因麦子蛋白质对热敏感较低,故只有见到较小的消化吸收最高值。得知随冻藏時间提升,谷蛋白的转性起止溫度明显上升6.3℃,其转性溫度Tp也由58.5℃明显上升至61.3℃,说明其超低温可靠性上升,这很有可能与冻藏造成 其亲水性官能团的曝露相关,与此同时其热露点温度明显减少,说明蛋白质井然有序水平减少,与谷蛋白二级结构的检测結果相一致。Wang等实验中面条蛋白质转性溫度随冻藏時间增加而减少,与此同时焓变有下降趋势,比照結果推断谷蛋白对冻藏期内的热转性溫度的提高具有关键功效。而γ-PGA组合理遏制了冻藏造成 的转性起止溫度上升,冻藏7星期过后促使转性溫度Tp扩大至65℃,较空缺组提高4℃,并发觉其热露点温度并沒有随冻藏時间增加而减少,这可能是γ-PGA合理遏制了谷蛋白互联网的劣变,进而缓解了热露点温度的减少。
2.5γ-PGA对谷蛋白流变学特点的危害
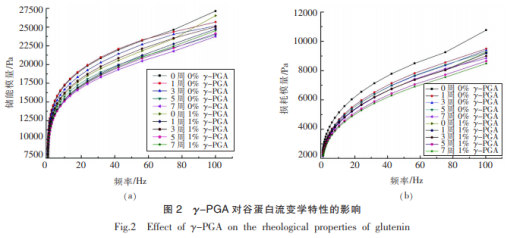
黏延展性被觉得是点评面糊质量的主要标准之一,而谷蛋白是弹力的关键奉献要素。谷蛋白流变学精确测量的弹性模具(G′)和粘性应变速率(G″)如图所示2所显示。与面条蛋白质相一致,谷蛋白在頻率0.1~100Hz范畴内其G′和G″都伴随着次数的提高慢慢扩大,且G′自始至终超过G″。当冻藏時间增加,谷蛋白的弹性模具(G′)和粘性应变速率(G″)均出現降低的发展趋势,这与Xuan等科学研究結果保持一致。而加入了1%的γ-PGA后,尽管冻藏前期谷蛋白的弹性模具(G′)小于空缺组,但其遭受冻藏危害的程度小,冻藏7星期过后其弹性模具(G′)比空缺组高,说明其合理遏制了冻藏造成 的谷蛋白延展性的减少,而粘性应变速率(G″)却与之反过来,在冻藏前后左右其粘性特性均小于空缺组,这说明γ-PGA并沒有对谷蛋白的粘性特性造成积极主动功效,先人科学研究也发觉面糊及面条蛋白质的弹力特性主要是由谷蛋白起首要奉献,故实验结果显示γ-PGA并无法根据更改谷蛋白的粘性特性来缓解冻藏期内面条蛋白质粘性特性的劣变,但还可以利用对谷蛋白延展性的干扰来抑止面条蛋白质延展性的变弱。
2.6γ-PGA对谷蛋白外部经济结构特征的危害
3为不一样冻藏周期时间谷蛋白外部经济框架图,冻藏前期谷蛋白根据链内和链外二硫键产生了高宽比数字化构造,使其具备持续的结构特征及较小的孔眼。随冻藏時间提升,发觉其外部经济构造受到损坏。冻藏5星期过后,谷蛋白互联网趋向破裂,发生显著结团状况,关键因素可能是冻藏期内冷藏收拢功效促使邻近的小冰霜汇聚产生大冰霜引起的构造破裂。与此对比,γ-PGA组到冻藏前期谷蛋白互联网孔眼增大,但依然展现不错的网络架构,这是由于γ-PGA具备优良的吸水能力而与谷蛋白中间产生了竞争吸湿,造成其孔眼直徑增大,但与空缺组不一样,随冻藏時间增加γ-PGA组的谷蛋白互联网的持续性比空缺更稳,且破裂得较少,γ-PGA优良的增稠特性造成水份停留实际效果,促使水份流通性减少可能是这其中的首要缘故。较持续的网络架构也使谷蛋白的耐热性提升,与以上实验結果相符合。与此同时说明γ-PGA合理减轻了冻藏期内谷蛋白的劣变,其实际效果将会在减缓面条蛋白质劣变中进行了奉献。
3结果
研究表明加上γ-PGA能够抑止冻藏期内谷蛋白水份的外流,促进谷蛋白中自由水向弱束缚水变换,提高其水份平稳水平,并合理缓解冻藏期内自由水扩大及弱束缚水成分的降低。与此同时γPGA合理减缓冻藏造成 的谷蛋白热露点温度减少,提高谷蛋白转性溫度,说明γ-PGA合理地保障了谷蛋白构造。并不错地抑止了冻藏引起的构造破裂和凝固状况,合理地保障了蛋白质互联网。冻藏造成 了谷蛋白延展性及粘性特性都随冻藏時间增加而减少,加上γ-PGA变弱了其延展性特性的下降趋势,但对粘性特性并沒有造成相对应功效。且γ-PGA合理缓解了冻藏造成 β-伸缩相对性成分减少,无规律打卷相对性成分扩大发展趋势,变弱了蛋白质二级结构由井然有序向混乱构造的转换水平。
文章版权备注
- 2023-05-01奶味香精的制备技术与开发现状
- 2023-04-04阿魏酸及其衍生物在食品添加剂领域研究进展(一)
- 2023-03-23甘肃省榆中县市场监督管理局强化食品快检 筑牢食品安全防线
- 2023-03-23常德:专项整治酒类市场12种违法行为
- 2023-03-23贵州这7批次食品检出食品添加剂问题,有食用植物调和油、冰糖大蒜、无油剁椒等
- 2023-03-23怀化:部署开展制止餐饮浪费专项行动
- 2023-03-23超90%展商已确认展位 6月食品原料展带来海内外商机
- 2023-03-23关于召开2023年国际食品安全与健康大会的通知
- 2023-03-23河南省市场监管局召开落实食品安全“两个责任”暨制止餐饮浪费专项行动调度视频会议
- 2023-03-23邵阳市食品安全“两个责任”机制推进暨野生蘑菇中毒防控部署电视电话会议召开


 豫ICP备19024296号
豫ICP备19024296号 售前咨询
售前咨询