发酵小麦胚芽产2,6-二甲氧基对苯醌菌种筛选及发酵条件优化(一)
小麦胚芽是小麦制粉过程中的主要副产物,营养价值丰富,其中高含量的蛋白质以及不饱和脂肪酸让小麦胚芽可作为蛋白补充剂与粮油制品的理想原料。但由于小麦胚芽中存在高活性的内源脂肪氧化酶、高含量的抗营养因子以及高水分活度,使得小麦胚芽难以直接作为食品加工原料得到有效利用,往往被作为饲料或废料处理。发 酵作为改良食品理化及加工特性的有效方法,在小麦胚芽上也得到了成功应用。发酵后的小麦胚芽中的植酸等抗营养因子的含量大大减少,脂肪酶和脂肪氧化酶的活性也得到显著抑制。研究还发现,小麦胚芽中的活性肽、多酚等功能活性物质的含量也在发酵后显著增加,具有降血脂、抗氧化、抗肿瘤等生理功能]。其中2,6-二甲氧基对苯醌(2,6-dimethoxy-ρ-benzoquinone,2,6-DMBQ)作为发酵小麦胚芽中主要的抗肿瘤活性成分而受到广泛关注。
2,6-DMBQ来源于小麦胚芽细胞内的水溶性氢醌糖苷。在发酵过程中,氢醌糖苷的糖苷键受微生物分泌的β-葡萄糖苷酶的作用断裂,并在过氧化氢酶的作用下生成2,6-DMBQ[13]。HIDV魪GI M等[14]在20世纪90年代利用面包酵母发酵小麦胚芽,对发酵产物加工后得到发酵小麦胚芽提取物并命名为Avemar。在后续的研究中,Avemar的抗肿瘤、抗氧化、提高免疫力的功效得到广泛证实,但对于Avemar具体的发酵工艺与发酵菌种却鲜有报道。国内学者经秀等]和国外学者RIZZELLO C G等[18]分别以酵母菌和乳酸菌为受试菌种进行产2,6-DMBQ菌种的筛选,最终得出高温酿酒酵母(Saccharomyces cerevisiae)和植物乳杆
菌(Lactobacillus plantarum)为最适发酵菌种,但是后续并没有对两种菌种产2,6-DMBQ的能力进行进一步比较。
本研究以小麦胚芽为原料,2,6-DMBQ产量为评价指标,从3株菌株中筛选最优发酵菌种,并考察3种原料前处理方式对2,6-DMBQ产量的影响。在此基础上,探究菌种添加量、料液比、发酵温度以及发酵时间4个发酵工艺因素对2,6-DMBQ产量的影响,并通过单因素试验及正交试验确定最适合发酵工艺组合,旨在为发酵小麦胚芽资源进一步开发利用提供试验依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
小麦胚芽:市售。
1.1.2 菌种
植物乳杆菌(Lactobacillus plantarum):实验室分离保存;高温酿酒酵母(Saccharomycescerevisiae)、低糖面包酵母:安琪酵母股份有限公司。
1.1.3 试剂
甲醇、氯化钠(均为分析纯):国药集团上海试剂有限公司;2,6-二甲氧基对苯醌标准品(纯度>97%):梯希爱上海化成工业发展有限公司;酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基、孟加拉红培养基、MRS肉汤培养基、MRS固体培养基:广东环凯微生物科技有限公司。
1.2 仪器与设备
RS-FS1401型多功能粉碎机:合肥荣事达小家电有限公司;LHS-250HC-11型恒温恒湿培养箱:上海一恒科学仪器有限公司;BSA 124S型精密分析天平:广州市授科仪器科技有限公司;Avanti J-26xp型高速离心机:美国Beckman公司;DHG-9053A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司;KQ-700DE型数控超声波清洗器:昆山市超声仪器有限公司;LDZM-80L-III型灭菌锅:上海申安医疗器械厂;LGJ-25G冷冻干燥机:北京四环福瑞科仪科技发展有限公司;M3-L233B微波炉:广东美的微波炉制造有限公司;Waters ACQUITY UPLC H-CLASS超高效液相色谱系统:美国Waters公司。
1.3 方法
1.3.1 小麦胚芽发酵工艺及操作要点
菌种活化
↓
小麦胚芽→粉碎→灭菌→预处理→接种→发酵
操作要点:
粉碎:将小麦胚芽粉碎后,过60目筛。灭菌:将小麦胚芽粉与超纯水按质量比1∶3充分混匀后在121 ℃条件下高压蒸汽灭菌15 min。预处理:将灭完菌的小麦胚芽与超纯水按照质量比1∶10再次混匀,按照后续试验设计进行不同处理。菌种活化、接种:将植物乳杆菌接入MRS肉汤,37 ℃条件下培养24 h,取200 μL培养液接入MRS肉汤培养基,37 ℃条件下培养24 h,连续活化培养2代后,按后续试验设计进行接种。高温酿酒酵母和低糖面包酵母在37 ℃温水中活化10 min后取200 μL接入YEPD培养基,28 ℃条件下培养24 h,连续活化培养2代后,按后续试验设计进行接种。发酵:按照后续试验设计分别在不同条件下进行发酵。
1.3.2 发酵菌种的筛选
植物乳杆菌:用无菌生理盐水将活化后的植物乳杆菌菌体浓度调节至1×104 CFU/mL,按菌种添加量1∶6(菌液与麦胚质量比,g∶g)添加到料液比为1∶15(麦胚与水质量比,g∶g)的小麦胚芽发酵基液中,37 ℃条件下发酵24 h。
酵母:用无菌生理盐水将活化后的高温酿酒酵母、低糖面包酵母的菌体浓度调节至1×104 CFU/mL,按菌种添加量1∶6分别添加到料液比为1∶15的小麦胚芽发酵基液中,28 ℃条件下发酵24 h。
取发酵液测定2,6-DMBQ产量,比较3株菌产2,6-DMBQ的能力,确定最适发酵菌种。
1.3.3 不同预处理方式对2,6-DMBQ产量的影响
在确定最适发酵菌种的基础上,以未作处理的小麦胚芽为空白对照,根据前期预试验结果,分别采用高温(95 ℃,30 min)、微波(700 W,5 min)、超声(功率100%,30 min)3种方法对小麦胚芽进行预处理。用无菌生理盐水将活化后的最适菌种的菌体浓度调节至1×104 CFU/mL,按菌种添加量1∶6添加到料液比为1∶15的小麦胚芽发酵基液中,28 ℃条件下发酵24 h。测定发酵液中2,6-DMBQ产量,以探究不同的预处理条件下是否有助于2,6-DMBQ产量的增加,确定最适预处理方式。
1.3.4 发酵条件优化单因素试验
在确定最适发酵菌种和预处理方式后进行发酵条件的研究,固定发酵条件为:菌种添加量1∶6、料液比1∶15、发酵时间24 h、发酵温度28 ℃,在此基础上,依次考察菌种添加量(1∶2、1∶4、1∶6、1∶8、1∶10)、料液比(1∶5、1∶10、1∶15、1∶20、 1∶25)、发酵温度(18 ℃、23 ℃、28 ℃、33 ℃、38 ℃)、发酵时间(18 h、24 h、30 h、36 h、42 h)对2,6-DMBQ产量的影响,确定
各因素的最适条件以进行正交试验。
1.3.5 发酵条件优化正交试验
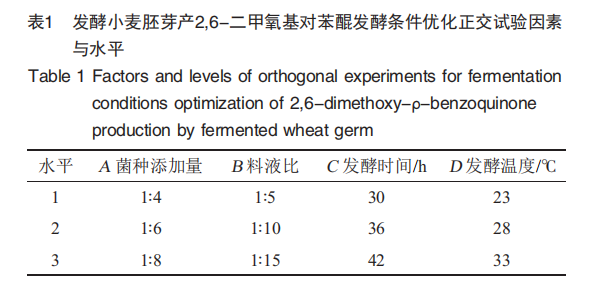
根据单因素试验结果,以2,6-DMBQ产量为评价指标,选取菌种添加量(A)、料液比(B)、发酵时间(C)、发酵温度(D)4个因素进行4因素3水平的L(9 34)正交试验设计,以确定最佳发酵条件组合,正交试验因素与水平见表1。
1.3.6 2,6-DMBQ产量的测定
样品的处理:将发酵液在8 000×g、4℃条件下离心15 min,取上清液冷冻干燥,然后加入20 mL甲醇于冻干物料中进行浸提,超声处理(功率100%,30 min)后,用0.22 μm滤膜过滤制得待测样品液进行测定。
参照经秀等[17]的方法进行了改进,采用超高效液相色谱(ultra performance liquidchromatography,UPLC)法测定2,6-DMBQ产量。UPLC条件:ACQUITY UPLC BEH C18色 谱柱(2.1 mm×100 mm1.7 μm),流动相为甲醇∶水=20∶80(V/V),流速0.2 mL/min,柱温35 ℃,进样量0.2 μL,检测波长
288 nm。以2,6-DMBQ的质量浓度(x)为横坐标,峰面积(y) 为纵坐标,绘制2,6-DMBQ标准曲线。2,6-DMBQ标准曲线的回归方程为y=48 102x-33 772,R2=0.999 4,说明2,6-DMBQ在1~100 μg/mL质量浓度范围内具有良好的线性关系,可用于2,6-DMBQ的定量。根据2,6-DMBQ标准品的保留时间进行定性。
文章版权备注
- 2023-05-01不同贮藏方式对红香酥梨采后生理及品质的影响(一)
- 2023-05-01奶味香精的制备技术与开发现状
- 2023-05-01双孢蘑菇液体菌种发酵及栽培效果浅析
- 2023-05-01菌种强化结合工艺优化提高酱香白酒基酒中四甲基吡嗪含量的研究(二)
- 2023-05-01猕猴桃中铁含量的测定与测定因素的探究
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(四)
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(三)
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(二)
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(一)
- 2023-05-01牡蛎中产广谱细菌素芽孢杆菌的筛选及鉴定(三)

 豫ICP备19024296号
豫ICP备19024296号 售前咨询
售前咨询