牡蛎中产广谱细菌素芽孢杆菌的筛选及鉴定(二)
1.3.5 重复片段基因指纹分析
以细菌基因组DNA为模板,参考Silva等的方法,利用设计的BOX引物(引物序列见表2)进行rep-PCR扩增。待扩增完成后,将PCR产物进行1.5%的琼脂糖凝胶电泳并在UV灯下观察电泳结果。

1.3.6 系统发育树
将校正并拼接后的序列在GenBank中进行同源序列的搜索,由rep-PCR得到的大致条带情况,从差异估计出发,采用层次UPGMA法(UnweightedPair-GroupMeanAverage),根据供试菌株的rep-PCR扩增条带的大小,采用二进制方法,生成系统发育树。
1.3.7 质粒提取
将产细菌素芽孢杆菌菌株过夜培养,利用质粒提取试剂盒(OMEGAbio-tek,上海),根据试剂盒上的介绍对过夜培养的产细菌素芽孢杆菌菌株进行质粒提取。将提取好的质粒DNA在1.5%的琼脂糖凝胶下进行电泳并在UV灯下观察电泳结果。
1.3.8 细菌素粗提
1.3.8.1 硫酸铵盐析沉淀法
按1%接种量将过夜培养好的产细菌素芽孢杆菌接种到250mL的BHI液体培养基中,置于30℃培养至少12h。将上述过夜培养好的菌液于4℃,10000r/min离心条件下离心25min,在上清液中添加45%的饱和硫酸铵搅拌溶解,置于4℃过夜。将过夜的溶液在10000r/min条件下离心30min,将沉淀溶解于5mL磷酸盐缓冲液PBS(pH6.86)中,即得到细菌素粗提物。
1.3.8.2 凝胶过滤层析
以SephadexG-25为凝胶填料,超纯水进行预洗脱后再用PBS洗脱柱子,细菌素粗提物5mL上样,流速0.5mL/min,先使用PBS进行洗脱,之后用0.2,0.5mol/L的氯化钠(NaCl)依次进行洗脱,收集洗脱液。分别对收集的洗脱液进行抑菌试验(吸取2μL粗提物抑制蜡样芽孢杆菌),将有抑菌效果的洗脱液进行冻干浓缩后复溶于pH6.86的PBS中置于-20℃备用。
1.3.9 三羟甲基甘氨酸-SDS-PAGE电泳(Tricine-SDS-PAGE)
参考Schagger等的方法,将冻干浓缩好的细菌素粗提纯物质在TricineSDS-PAGE进行电泳。其中胶质量分数分别为夹层胶10%,浓缩胶4%,分离胶16.5%。采用分子质量3.3~20.1ku的肽Marker(Solarbio)作为标准对照。电泳结束后使用考马斯亮蓝G250进行染色脱色,将电泳胶在Bio-rad成像系统下记录结果。
1.3.10 液相色谱-串联质谱联用
将产细菌素芽孢杆菌菌株在30℃条件下过夜培养,将培养好的菌液在10000r/min条件下离心30min,取上清液加热15min处理后,参考Sun等的方法,将上清液通过液相色谱-串联质谱联用分析蛋白质分子质量。利用现有蛋白质组学信息库(Omicsbean)对获得的蛋白质进行对比分析。
2 结果与讨论
2.1 产细菌素菌株的筛选及鉴定
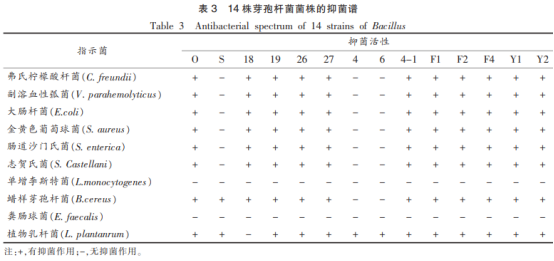
从牡蛎中初步筛选出的对常见食源性致病菌有抑菌活性的菌株有14株(命名为O、S、18、19、26、27、4、6、4-1、F1、F2、F4、Y1、Y2)。这些细菌在平板上具有典型的芽孢杆菌形态,即菌体扁平、粗糙不透明、边缘不整齐、微黄色,且革兰氏染色后结果均呈阳性。这14株菌对常见致病菌的抑菌谱见表3。其中O、18、19、26、27、4-1、F1、F2、F4、Y1、Y2等菌株具有广谱抑菌性,不仅对金黄色葡萄球菌(S.aureus)、蜡样芽孢杆菌(Bacilluscereus)、植物乳杆菌(L.plantanrum)等革兰氏阳性菌具有较好的抑菌效果,而且对弗氏柠檬酸杆菌(C.freundii)、副溶血性弧菌(V.parahemolyticus)、大肠杆菌(E.coli)、肠道沙门氏菌(S.enterica)、福氏志贺氏菌(Shigellaflexneri)等革兰氏阴性菌也具有很好的抑制作用。另外,由表3还可以看出,菌株18、19、26、27具有相似的抑菌谱,菌株F1、F2、F4、Y1、Y2等抑菌能力也十分相似。
将具有抑菌活性的细菌送检测序,其测序结果经过在NCBI上进行Blast序列比对,发现这14株指标菌株与芽孢杆菌属同源性最高,均高达99%以上,可初步判断其均属于芽孢杆菌属。其中,O为解淀粉芽孢杆菌(B.amyloliquefaciens),18、19、26、27以及F1、F2、F4、Y1和Y2等菌株均为枯草芽孢杆菌(B.subtilis),4、6、S分别为短小芽孢杆菌(B.pumilus)、厦门芽孢杆菌(B.xiamenensis)、蜡样芽孢杆菌(B.cereus),4-1为死亡谷芽孢杆菌(B.vallismortis)。
2.2 细菌素对热和酶的稳定性测试
细菌生长过程中产生的抑菌物质除了细菌素外,还可以代谢产生有机酸、抗生素和H2O2等其它具有抑菌活性的物质。为了排除其它干扰因素,通过加热处理和酶处理方式确定抑菌物质为细菌素。筛选出的14株菌在加热后保持较好的抑菌活性。此外,经过蛋白酶K处理的平板点菌处抑菌圈不完整,这一结果说明抑菌活性物质是热稳定性强的细菌素。
2.3 重复片段基因指纹分析(rep-PCR)和系统发育树构建
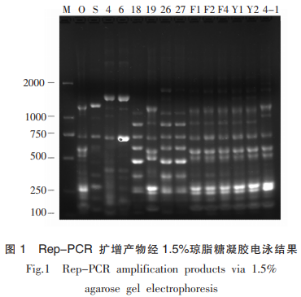
为了确定同一种属的细菌基因型是否一致,本试验通过利用特殊设计的引物即BOX引物对抑菌谱相似且鉴定结果相似的菌株的DNA进行rep-PCR扩增,确定其相应的基因图谱,以便进一步对细菌进行区分。Rep-PCR扩增产物经琼脂糖凝胶电泳后的结果如图1。结果显示,18、26、27的扩增产物基因图谱基本一致,即重复片段基本一致,可以初步判断为一种菌;F1、F2、F4、Y1、Y2等菌株的基因图谱也呈现出一致性,可判断为同一种菌;4-1与F1、F2、F4、Y1、Y2的rep-PCR扩增产物在<1.0kb相似,但在>1.0kb处条带略有不同,初步判断是同属但不同种的菌;O、S、4、6、4-1的条带各不相同,可以判断为同一种属的不同菌。
根据rep-PCR扩增条带结果,采用二进制方法,利用UPGMA软件构建得到相应的系统发育树(如图2)。结果显示菌株Y1、F4、Y2、F2、F1的同源性较高,另外,菌株18、26、27位于一个分支簇,该结果与rep-PCR结果一致。鉴于rep-PCR基因指纹图谱和系统发育树的结果,结合芽孢杆菌抑菌谱范围,可以初步判断O、19、F和4-1与其它细菌不同,因此后续将选用这4株产细菌素芽孢杆菌用于进一步试验。

2.4 质粒提取
细菌素是通过核糖体合成产生的抑菌物质。通常情况下细菌素通过在染色体上编码产生,也可以通过质粒产生,也有一些细菌素的合成是受染色体和质粒的双重调控产生。为了确定上述细菌素产生的位置,本试验通过提取质粒中DNA,初步判断编码细菌素的基因是否位于质粒,以便于进一步对编码细菌素的基因序列或者结构分析提供依据。结果发现,这4株细菌未发现质粒。这一结果说明这些芽孢杆菌主要是通过染色体上的编码基因产生细菌素。
声明:本文所用图片、文字来源《中国食品学报》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系
相关链接:芽孢杆菌,弗氏柠檬酸杆菌,沙门氏菌,磷酸盐
文章版权备注
- 2023-05-01不同贮藏方式对红香酥梨采后生理及品质的影响(一)
- 2023-05-01奶味香精的制备技术与开发现状
- 2023-05-01双孢蘑菇液体菌种发酵及栽培效果浅析
- 2023-05-01菌种强化结合工艺优化提高酱香白酒基酒中四甲基吡嗪含量的研究(二)
- 2023-05-01发酵小麦胚芽产2,6-二甲氧基对苯醌菌种筛选及发酵条件优化(一)
- 2023-05-01猕猴桃中铁含量的测定与测定因素的探究
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(四)
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(三)
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(二)
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(一)

 豫ICP备19024296号
豫ICP备19024296号 售前咨询
售前咨询