我国的赖氨酸菌种研发起步较晚,菌种性能提升仍然主要依赖于传统的诱变育种技术,赖氨酸龙头企业研发力量薄弱,由企业主导的研发投入严重不足,运用现代代谢工程改造技术的能力较低,导致企业主要的自有生产菌种水平与国外差距较大。但是随着生物学科在系统生物学和合成生物学领域的快速发展,以及我国鼓励科研创新、加大科研投入力度的政策引导下,我国一批高等院校和科研机构在生物技术领域快速赶上,在微生物基因组高效编辑技术和精确重编程、精细调控方面取得了一系列重要成果和突破,相关研究达到国际先进水平。在赖氨酸菌种研发方面,中国科学院天津工业生物技术研究所、中国科学院上海生命科学研究院植物生理生态研究所、中国科学院微生物研究所,以及江南大学、天津科技大学等在代谢途径关键酶解除反馈抑制、代谢途径优化、菌种的发酵环境适应性改造等方面取得了一系列进展,为新一代赖氨酸工业菌种的研发奠定了良好基础。
四、知识产权现状与风险
赖氨酸菌种的核心知识产权超过600个专利家族,分别集中在味之素、赢创德固赛、希杰等国外大公司手中,且布局完整全面;相比之下,我国的菌种的核心专利申请量不足2%,这反映出我国缺乏知识产权保护意识,在代表核心竞争力的菌种专利方面布局极其薄弱。因此知识产权风险是我国赖氨酸工业面临的另一个重大危机。
1、知识产权现状
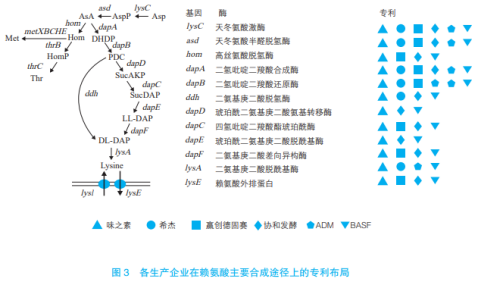
早在20世纪90年代,味之素公司便开始了大肠杆菌产赖氨酸的专利申请和保护,随着研发的不断深入,其专利申请量也不断增加,2000年左右其已经对赖氨酸主要合成途径的技术形成了全面的保护。协和发酵、赢创德固赛、希杰公司也都在谷氨酸棒杆菌产赖氨酸方面进行了大量的专利申请和布局,部分如图3所示。同时,由于历史原因,早期菌种改造专利获得授权的保护范围极大,例如,味之素公司在专利WO2005010175中保护了含有不能正常发挥功能的苹果酸酶的埃希氏菌生产L-赖氨酸的方法,其中对不能正常发挥功能的描述既包括了功能被去除、也包括减弱,而且所述的苹果酸酶序列扩大到了大肠杆菌来源的sfcA或b2463基因编码的蛋白序列通过取代、缺失、插入或添加一个或数个(2~20个)氨基酸残基衍生的苹果酸酶,该同族专利在中国、美国、欧洲都获得了授权。由于国际大公司已有专利对赖氨酸合成途径的主要代谢步骤都进行了全方位的保护,这对后来者开发提升相关菌种制造了极大的专利壁垒,使得后来者侵犯专利的风险显著提高,突破专利封锁的空间被进一步压缩。
此外,国外公司的专利普遍存在以下特点:①非常注重专利质量,所申请专利中高品质专利居多;②对全技术链条予以保护,从上游关键酶(如lysC)、工程菌株的构建方法(解除反馈抑制的LysC、DapA以及DapB、Ddh),到下游的发酵及分离提取工艺,再到菌株和方法的应用都进行了保护;③结合产业和市场特点进行了严密的专利布局,关键技术在生产国、销售国(如中国、美国)都进行了专利申请和布局,充分保护自身销售权益,且一般在有效期内均对专利进行维护。反观国内公司,专利质量普遍不高,且很多公司在专利申请几年后就终止了专利的维护,自动放弃了专利权益。
2、赖氨酸专利诉讼情况
近年来,由于我国赖氨酸出口总量的不断增加,国外企业如味之素、希杰、ADM等公司因价格、利润等影响,其市场份额被压缩。在此情况下,国际大公司转而通过专利诉讼压制中国企业的发展。早在2006年,味之素公司就开始诉讼我国当时第一大赖氨酸生产企业大成生化公司侵犯其美国专利US6040160及US5827698,经过持久的诉讼过程,大成生化公司2017年6月30日发布公告称其与味之素公司就涉嫌侵犯若干专利及违反商业秘密官司达成和解。2017年韩国希杰公司与宁夏伊品公司知识产权之战硝烟再起,希杰公司起诉伊品公司侵犯其专利EP2102337和ZL200980103315.6,2017年12月,这场专利战争以宁夏伊品公司支付希杰公司高额技术许可费得以和解。2017年12月8日和9日,希杰公司在中国和德国对诸城东晓生物科技有限公司再次发起专利侵权诉讼。国内龙头企业经历多次赖氨酸知识产权诉讼后终于意识到知识产权的重要性,纷纷提出开发具有自有知识产权赖氨酸菌种。
不具有独立知识产权的赖氨酸菌种技术,已经成为制约国内拥有数百万吨产能、数万从业人员的赖氨酸产业生存发展的“卡脖子”技术。在这种情况下,中国科学院通过“STS行动”计划、科技部通过“863”计划立项支持氨基酸菌种研发。中国科学院天津工业生物技术研究所针对赖氨酸合成关键酶LysC进行理性设计,发现了解除反馈抑制的重要突变位点D340,并对该技术进行了PCT专利申请,已经在日本、美国、加拿大获得授权,实现了我国赖氨酸核心专利零的突破。宁夏伊品公司研发了弱化乌头酸酶生产L-赖氨酸的方法,并申请了专利[18],除在中国进行专利布局外,还在欧洲、美国、韩国、日本、加拿大等进行了专利布局。
五、合成生物学技术助力赖氨酸产业升级
合成生物学的快速发展为赖氨酸工业菌种革新带来了新的发展机遇,近期我国科学家接连在工业底盘谷氨酸棒杆菌和大肠杆菌的基因组规模研究中取得新突破,为开发自主知识产权的新一代赖氨酸工业菌种迎来曙光。2017年6月中国科学院微生物所温廷益实验室发表了最新的谷氨酸棒杆菌基因组规模代谢网络模型iCW773,其可助力基因组规模理性设计赖氨酸菌种。基因组规模的菌种改造需要借助高效的基因组编辑技术,但传统的谷氨酸棒杆菌基因组遗传改造步骤繁琐、效率低。2017年5月中国科学院上海植物生理生态研究所杨晟实验室率先在NatureCommunications上发表谷氨酸棒杆菌的CRISPR-Cpf1基因组编辑技术;随后中国科学院天津工业生物技术研究所孙际宾实验室首次在谷氨酸棒杆菌中建立了基于CRISPR-Cas9的高效基因组编辑技术,并结合CRISPR/nCas9-AID和自动化操作平台在谷氨酸棒杆菌中建立了多元自动化碱基编辑技术MACBETH。这些研究成果预示着我国已经掌握了基因组规模的菌种设计和改造实力。2018年11月,科技部发布指南立项支持合成生物学重点研发计划,可以预期在未来3~5年我国的合成生物学技术将出现长足进步,利用合成生物技术创建具有自主知识产权的高性能赖氨酸工业菌种的前景已经越来越清晰。
综上所述,传统的遗传诱变育种技术催生了我国初期的赖氨酸工业,基于分子生物学和DNA重组技术针对已知关键酶和关键途径改造的基因工程代谢工程为国外几家氨基酸公司赢得了近几十年来赖氨酸产业的霸主地位,而我国快速发展的新一代合成生物学技术将实现对赖氨酸生产菌种从全基因组规模的设计和改造,为大幅提升菌种性能打下坚实的基础。同时结合知识产权风险防范分析,构筑自有知识产权布局,将彻底改变我国过去赖氨酸工业产量全球第一却严重缺乏核心技术的尴尬局面。我国实现赖氨酸工业的弯道超车未来可期。
声明:本文所用图片、文字来源《中国食品添加剂》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系
相关链接:赖氨酸,大肠杆菌,苹果酸酶,埃希氏菌
文章版权备注
- 2023-05-01不同贮藏方式对红香酥梨采后生理及品质的影响(一)
- 2023-05-01奶味香精的制备技术与开发现状
- 2023-05-01双孢蘑菇液体菌种发酵及栽培效果浅析
- 2023-05-01菌种强化结合工艺优化提高酱香白酒基酒中四甲基吡嗪含量的研究(二)
- 2023-05-01发酵小麦胚芽产2,6-二甲氧基对苯醌菌种筛选及发酵条件优化(一)
- 2023-05-01猕猴桃中铁含量的测定与测定因素的探究
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(四)
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(三)
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(二)
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(一)

 豫ICP备19024296号
豫ICP备19024296号 售前咨询
售前咨询