原创:《业务常见专业技术问题集锦》—酸碱中和滴定

点击观看课程视频
一、实验原理
中和反应中H++OH-=H2O,当n(H+)=n(OH-), 完全中和;对于一元酸与碱反应时:c酸V酸=c碱V碱
注意:准确测出参加反应的两种溶液的体积和判断中和反应是否恰好进行完全。
二、重要仪器
1. 酸碱中和滴定所需的仪器 :酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、移液管洗耳球。
2. 量取液体常用仪器:量筒、移液管、滴定管
量筒:粗量仪,10mL量筒最小分刻度为0.1mL、 读数精确到0.1mL,无“0”刻度;
移液管:精量仪,读数精确到0.01mL;
滴定管:
标有温度、容积、“0”刻度在最高点;
常用规格:25mL、50mL;
最小分刻度:0.1mL,读数精确到0.01mL(精量仪可估读一位,粗量仪不能估读)。
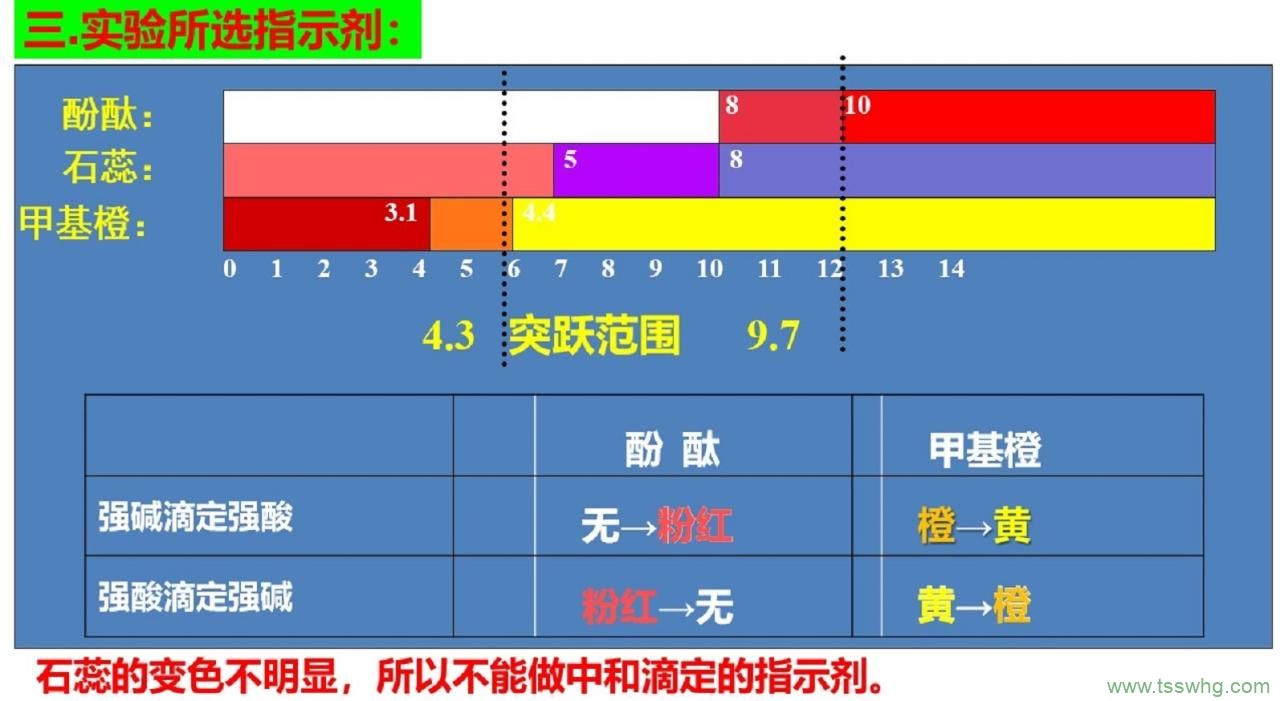
三、指示剂选择:(如下图示)
四、实验操作
1. 滴定管的准备
润 洗:用标准液或待测液分别润洗酸式滴定管和 碱式滴定管。
调 液:调节液面至零或零刻度线以下。如果尖嘴部分有气泡,要排出气泡。
读 数:视线和凹液面最低点相切(平视)。
锥形瓶的准备:洗涤后,用滴定管注入一定体积的待测溶液到锥形瓶中,滴加2-3滴指示剂。
2. 滴定操作
取标准盐酸溶液:
用标准液润洗酸式滴定管1~2次;注入标准液至“0”刻度线以上,固定在滴定管夹上;
迅速转动活塞将尖嘴气泡排除并调整液面在“0”刻度以下,记下准确读数。
取待测NaOH溶液:
用待测液润洗碱式滴定管1~2次,注入待测液至“0”刻度线以下;固定在滴定夹上;
迅速挤压玻璃球,将尖嘴气泡排出;
调整液面在“0”或“0”刻度线以下,准确记下读数。
往洁净的锥形瓶内准确放入25.00毫升的碱液。
3、滴定至终点—记录读数—重复2-3次。
注意:左手控制活塞,活塞朝右,滴液先快后慢;右手持锥形瓶,不断旋转;用眼观察锥形瓶中的颜色变化和滴定的速度;滴定终点判断:溶液颜色发生变化且在半分钟内不恢复。
四、计算:根据公式cHClVHCl=cNaOHVNaOH
声明:本文所用图片、文字部分来源于网络,版权归原作者所有。如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为放弃相关权利。
文章版权备注
- 2023-05-01不同贮藏方式对红香酥梨采后生理及品质的影响(一)
- 2023-05-01奶味香精的制备技术与开发现状
- 2023-05-01双孢蘑菇液体菌种发酵及栽培效果浅析
- 2023-05-01菌种强化结合工艺优化提高酱香白酒基酒中四甲基吡嗪含量的研究(二)
- 2023-05-01发酵小麦胚芽产2,6-二甲氧基对苯醌菌种筛选及发酵条件优化(一)
- 2023-05-01猕猴桃中铁含量的测定与测定因素的探究
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(四)
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(三)
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(二)
- 2023-05-01腐植酸调节砷酸盐生菜毒性作用研究(一)

 豫ICP备19024296号
豫ICP备19024296号 售前咨询
售前咨询