响应面法酶解藜麦蛋白制备α-淀粉酶抑制肽的工艺研究(二)
二、結果与剖析
1、黎麦获取胰蛋白酶解制取活性多肽結果
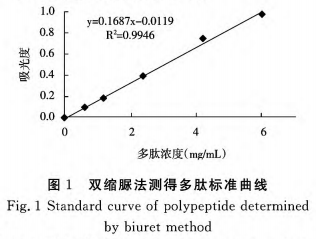
(1)活性多肽成分标曲的制作
由图1可获得线性方程为,y=0.1687x—0.0119,相关系数r为R2=0.9946。式中:y为OD值A;x为牛血清蛋白浓度值,mg/mL。
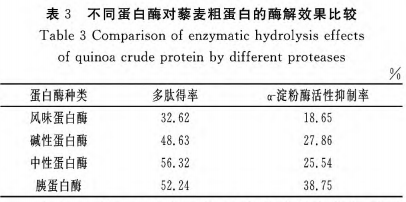
(2)胰蛋白酶的挑选
由表3得知,4种酶酶解后的活性多肽提取率都超出了30%,对α-胃蛋白酶活力具备一定的抑制效果,表明4种酶对黎麦蛋白质都有着非常明显的酶解实际效果,在其中中性蛋白酶和蛋白酶的活性多肽得率超出50%,而碱性蛋白酶和蛋白酶酶解后的抑制率较口味胰蛋白酶和中性蛋白酶高,蛋白酶解水平越大,活性多肽提取率也越高,转化成的低分子结构肽段就越大,具备抑止活力的肽段非常容易被溶解造成抑止活力减少。充分考虑二种要素,挑选蛋白酶开展下一步的酶解实验。
(3)蛋白酶单要素酶解标准科学研究
酶解時间、酶解溫度、pH、加酶量对α-胃蛋白酶活力抑制率和活性多肽得率功效实际效果见图2~图5。
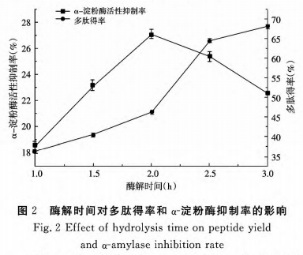
①酶解時间对酶解实际效果的危害
由图2得知,伴随着酶解時间的增加,活性多肽得率慢慢上升,这表明在蛋白液浓度值一定的标准下,酶解時间的增加使酶与蛋白的功效的时间越充足,蛋白被溶解的水平大,转化成小分子水精彩片段的短肽越多,进而其活性多肽成分逐步上升。在1~3h中间酶解速度慢慢提升,在酶解前期,蛋白液中残存的含糖量、生物大分子蛋白质会沉积在量杯底端,伴随着酶与底端生物大分子蛋白质充足触碰,酶解速度快速提升。α-胃蛋白酶活力抑制率发生先上升后下降的发展趋势,在酶解時间为2h时,α-胃蛋白酶活力抑制率做到最高值27.1%,伴随着酶解的连续开展,以前酶解获得的α-胃蛋白酶抑止肽被酶解得更小分子水的肽段,进而活力抑制率减少。考虑到二种酶解实验結果,挑选酶解时问2h为最好。
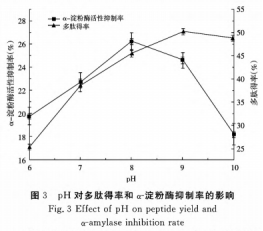
②pH对酶解实际效果的危害
pH的更改干扰了酶的适宜反映标准,易使酶降解和溶解,从而导致酶解反映的中断。由图3得知,活性多肽提取率和α-胃蛋白酶活力抑制率都出現了先上升后降低的发展趋势,在pH8.0时活性多肽提取率和α-胃蛋白酶活力抑制率都超过最大值,以后旷胃蛋白酶抑制率快速减少,活性多肽得率趋向轻缓并略微减少,因为偏酸过碱的条件会使酶的活性位置遭受损坏或离解,pH对酶解实际效果尤为重要。因而,选中蛋白酶的酶解pH为8.0开展酶解。
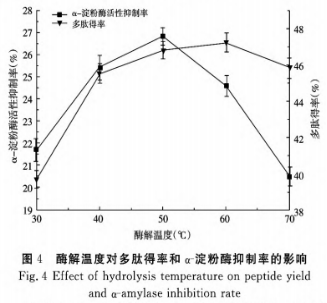
③酶解溫度对酶解实际效果的危害
由图4得知,活性多肽得率展现不断上升发展趋势,因为溫度的上升扩大了酶与蛋白质分子结构的触碰机遇,酶的活性也随着提高,活性多肽得率慢慢上升,α-胃蛋白酶活力抑制率也随着上升,在50℃做到最高值26.8%,接着发生减少,溫度超出60℃很有可能会立即使小分子活性肽进一步离解,缺失抑止活力,进而使α-胃蛋白酶活力抑制率降低。因而,挑选酶解溫度在50℃上下。
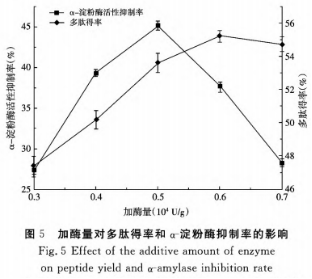
④加酶量对酶解实际效果的危害
由图5得知,伴随着加酶量的提升,活性多肽得率逐步升高,α-胃蛋白酶活力抑止首先升高后降低,扩大加酶量促使酶与底物蛋白质分子结构充足触碰,一些沉积在底边的生物大分子蛋白质也伴随着被水解反应,而随着加酶量进一步提升,一些具备α-胃蛋白酶活力抑止的肽段也随着被溶解为更小分子结构的短肽,旷胃蛋白酶活力抑制率发生减少。当加酶量在0.5×104U/g时,α-胃蛋白酶活力抑止做到最高值45.1%。因而,挑选加酶量在0.5×104U/79较为适合。
文章版权备注
- 2023-05-01奶味香精的制备技术与开发现状
- 2023-04-04阿魏酸及其衍生物在食品添加剂领域研究进展(一)
- 2023-03-23甘肃省榆中县市场监督管理局强化食品快检 筑牢食品安全防线
- 2023-03-23常德:专项整治酒类市场12种违法行为
- 2023-03-23贵州这7批次食品检出食品添加剂问题,有食用植物调和油、冰糖大蒜、无油剁椒等
- 2023-03-23怀化:部署开展制止餐饮浪费专项行动
- 2023-03-23超90%展商已确认展位 6月食品原料展带来海内外商机
- 2023-03-23关于召开2023年国际食品安全与健康大会的通知
- 2023-03-23河南省市场监管局召开落实食品安全“两个责任”暨制止餐饮浪费专项行动调度视频会议
- 2023-03-23邵阳市食品安全“两个责任”机制推进暨野生蘑菇中毒防控部署电视电话会议召开

 豫ICP备19024296号
豫ICP备19024296号 售前咨询
售前咨询